- Tác giả Alex Aldridge [email protected].
- Public 2023-12-17 13:53.
- Sửa đổi lần cuối 2025-01-23 12:14.
Sự khác biệt chính giữa axit cacbonic và bicacbonat là axit cacbonic là một hợp chất hóa học trung tính, trong khi bicacbonat là một hợp chất hóa học mang điện tích âm.
Axit cacbonic là một axit yếu tạo thành dung dịch khi cacbon đioxit hòa tan trong nước, có công thức hóa học là H2CO3. Bicacbonat tạo thành do sự kết hợp của ba nguyên tử oxy, một nguyên tử hydro và một nguyên tử cacbon có công thức hóa học là HCO3 -.
Axit cacbonic là gì?
Axit cacbonic là H2CO3. Đôi khi, chúng tôi đặt tên này cho các dung dịch có carbon dioxide hòa tan trong nước hoặc nước có ga. Điều này là do nước có ga chứa một lượng nhỏ H2CO3. Hơn nữa, axit cacbonic là một axit yếu và nó có thể tạo thành hai loại muối là cacbonat và bicacbonat. Khối lượng mol của hợp chất này là 62,024 g / mol.
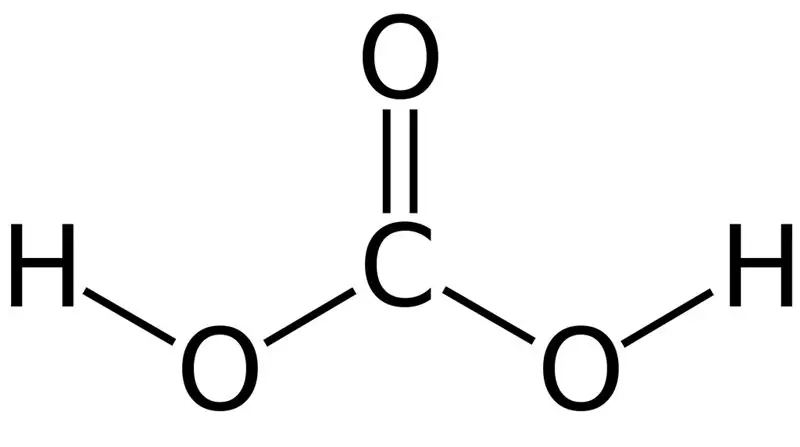
Hình 01: Cấu trúc hóa học của axit cacbonic
Khi carbon dioxide hòa tan trong nước, nó đi vào trạng thái cân bằng giữa carbon dioxide và axit cacbonic. Trạng thái cân bằng như sau:
CO2 + H2O ⟷ H2CO3
Nếu chúng ta thêm một lượng dư axit cacbonic vào một bazơ, nó sẽ tạo ra bicacbonat. Nhưng, nếu có một lượng dư bazơ, thì axit cacbonic có xu hướng tạo ra các muối có ga. Chính xác hơn, axit cacbonic là một hợp chất axit cacboxylic có hai nhóm thế hydroxyl gắn với cacbon cacbonyl. Hơn nữa, nó là một axit polyprotic, có khả năng hiến tặng proton. Nó có hai proton có thể tháo rời, vì vậy nó đặc biệt là diprotic.
Bicarbonate là gì?
Bicarbonate hình thành do sự kết hợp của ba nguyên tử oxy, một nguyên tử hydro và một nguyên tử carbon. Sản phẩm của sự kết hợp này có thể là một ion hoặc một hợp chất có nhiều electron hơn proton. Chúng ta có thể mô tả nó như một loài hóa học có công thức hóa học HCO3 -.
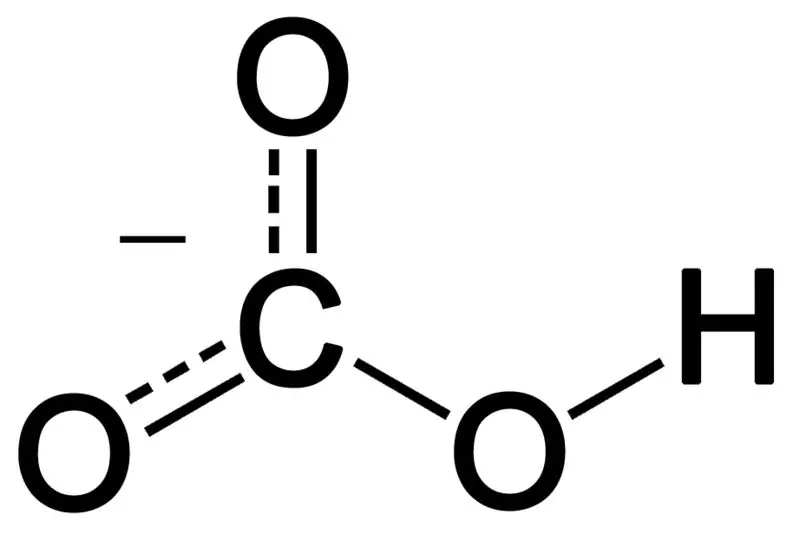
Hình 02: Cấu trúc hóa học của Bicarbonate Anion
Hợp chất này là một phần quan trọng của hệ thống đệm pH của cơ thể, theo thuật ngữ của người dân: nó có trách nhiệm giữ cho máu của một người ở trạng thái không quá axit hoặc quá bazơ. Ngoài ra, nó còn là một cách để giữ cho dịch tiêu hóa được kiểm soát khi dạ dày đã tiêu hóa xong thức ăn. Hơn nữa, axit cacbonic trong nước mưa tạo thành các ion bicacbonat khi nó va vào đá. Dòng ion bicacbonat này rất quan trọng trong việc duy trì chu trình cacbon.
Sự khác biệt giữa Axit cacbonic và Bicacbonat là gì?
Axit cacbonic là một axit yếu tạo thành trong dung dịch khi cacbon đioxit hòa tan trong nước, và công thức hóa học của nó là H2CO3. Bicacbonat tạo thành do sự kết hợp của ba nguyên tử oxy, một nguyên tử hydro và một nguyên tử cacbon có công thức hóa học là HCO3-. Sự khác biệt chính giữa axit cacbonic và bicacbonat là axit cacbonic là một hợp chất hóa học trung tính, trong khi bicacbonat là một hợp chất hóa học mang điện tích âm. Hơn nữa, axit cacbonic được sử dụng trong sản xuất đồ uống sủi bọt, có ga, xử lý da, nước súc miệng, v.v., trong khi bicacbonat được sử dụng trong các chế phẩm thực phẩm như nướng (như một chất tạo men), và nó có khả năng chống lại sự thay đổi của độ pH.
Đồ họa thông tin sau đây tóm tắt sự khác biệt giữa axit cacbonic và bicacbonat ở dạng bảng để so sánh song song.
Tóm tắt - Axit cacbonic vs Bicacbonat
Axit cacbonic là H2CO3. Bicacbonat tạo thành do sự kết hợp của ba nguyên tử oxy, một nguyên tử hydro và một nguyên tử cacbon, với công thức hóa học là HCO3-. Sự khác biệt chính giữa axit cacbonic và bicacbonat là axit cacbonic là một hợp chất hóa học trung tính, trong khi bicacbonat là một hợp chất hóa học mang điện tích âm.






